更新时间:2016-04-22 17:01 浏览: 次 作者:admin 文章来源:未知
研究者LeahN等人期望能鉴定出药理学分子伴侣(PCs),使cryAB以可溶形式稳定下来从而发挥其抑制cryAB聚集的作用。然而cryAB缺少天然底物并且不具有酶活力,难以进行高通量筛选。
他们尝试使用差示扫描荧光测定法(DSF)来解决这个难题。为了观察高通量DSF在寻找cryAB分子伴侣中是否有益,研究者们首先纯化了人R120G-cryAB重组蛋白和野生型cryAB,并证实了它们都是可溶性的。通过光散射和电子显微镜观察,经过微微加热,人R120G-cryAB比野生型的cryAB更易形成淀粉样蛋白。而淀粉样蛋白拥有更耐热结构,由此猜想R120G-cryAB应该更难溶解。
为了验证这个可能性,又使用ThermoFluor对两者进行加热,结果与前面一致,对照cryAB的可熔温度为64.1°± 0.5°C,而R120G-cryAB的对应温度为68.3°± 0.2°C。基于此结果,科学家们认为分子伴侣是能够降低R120G-cryAB可熔点的最优选择。
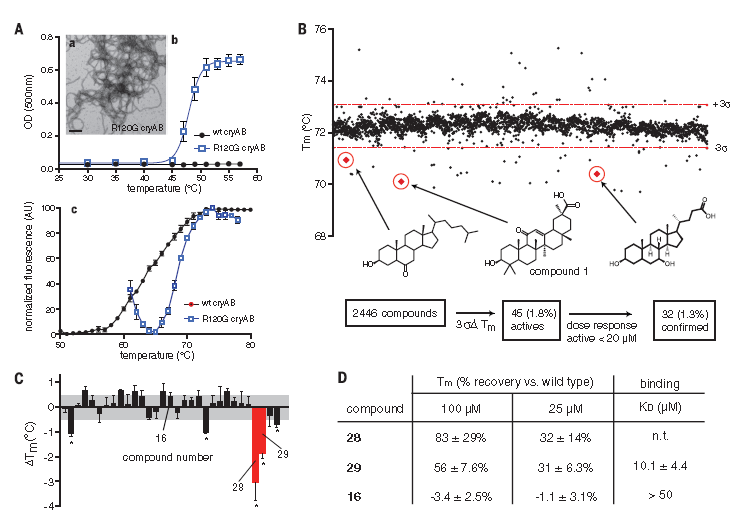
在pilot screens实验中,尽管Hsp27蛋白在cryAA和cryAB中拥有高度保守的晶状体蛋白结构域,但考虑到它高达72°C的熔点,研究者们还是选择了Hsp27蛋白模型,继而从约2450种化合物中筛选鉴定出45种熔点明显下降的化合物 (图1B) ,通过剂量-依赖实验将熔点降低的活性物缩小为32种,并进一步确定了其中的12种活性物属于甾醇类化合物,对其进行更深入的研究,确定了其中一类弱活性的甾醇类物质为羊毛甾醇。
Zhao等人曾报道过羊毛甾醇具有抗白内障的活性。由于该化合物的可溶性有限,且只在HT-DSF实验中显示微弱的活性。这促成了实验者们再一次的筛选。如图1C所示,两种化合物(分别为28和29)至少比甾醇1活性高2~3倍,熔点至少下降了2°C。其他种甾醇类比如16号化合物虽然与28、29号化合物的结构相似,但其活性却较差。
为了更近一步确认29号化合物与R120G-cryAB是否直接互作,实验人员使用了双分子层干涉法,结果显示固定的R120G-cryAB与29号化合物结合,电离常数Kd值为10.1 ± 4.4 mM(图1C),而16号化合物却未结合。
用29号化合物、16号化合物(100mM)来处理R120G-cryAB(15mM),使用电镜检查后续聚集程度。结果表明是29号化合物而非16号化合物在聚合过程开始前抑制了淀粉样蛋白的形成,同样的,在聚合前阶段也是29号化合物在发挥作用(图2A)。这些体外实验均表明了29号化合物能够阻碍聚合过程,部分逆转R120G-cryAB的不可溶性。
实验人员通过对回补R120G-cryAB的小鼠进行了为期2周,每周3次的化合物处理来观察29号化合物能逆转上述过程。所有小鼠在治疗前均已患有严重的白内障。使用视频裂隙灯对晶状体的状况进行跟踪并使用改编自晶状体浑浊分类系统III(LOCS III)的5等评分法进行评分。如图2C可见,29号化合物的治疗效果显著,明显提高了晶状体透明度。说明29号化合物能部分修复老龄R120G-cryAB杂合鼠的晶状体透明度。
为了检验29号化合物能否修复该蛋白可溶性,通过离心分离、测量晶状体数量先区分开可溶与不可溶的晶状体。结果显示29号化合物能提高α-晶状体蛋白63%的可溶性,并且不影响蛋白的正常结构。后续实验也表明29号化合物在非手术治疗遗传学和年龄相关性的白内障治疗中均表现出较大潜力。
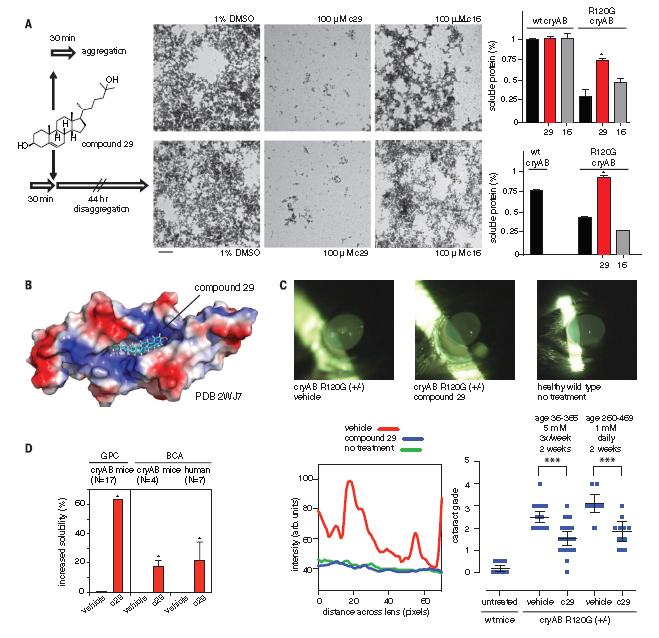
29号化合物是晶状体蛋白cryAA和cryAB的分子伴侣。通过体外、体内和间接体内实验,研究者们确定了29号化合物能使cryAB形式稳定,而一旦两者结合产出稳定状态时,cryAB发生错误折叠的可能性就会大大的降低。
该篇报道指出药理学分子伴侣能够改善晶状体的透明度,为治疗治疗白内障提供了一种可靠的方法;同时该项研究也为鉴定PCs提供了的理想依据。
上一篇:国人顶级发现【聚焦】脂代谢