更新时间:2016-04-22 17:04 浏览: 次 作者:admin 文章来源:未知

所有的药物都有引起副作用的可能,这种副作用也称为“药物不良反应”,但并不是所有这些反应都是过敏性质的。其他反应有异质的、假性过敏的或药物不耐受所引起。英国变态反应与临床免疫学会(BSACI)将药物过敏定义为一种已建立免疫机制的药物不良反应。从临床病史的角度来看,其所呈现的机制可能并不是显而易见的,而且在没有研究的情况下我们并不总是能够确定一种药物反应是过敏性的还是非过敏性的。因此,有报道将药物过敏定义为具有临床特征或免疫机制的药物所引起的任何反应。
药物不良反应是临床用药过程中遇到的棘手问题,这当中免疫系统参与所导致的药物过敏反应约占药物不良反应发生率的1/6。美国一项调查报告显示其国内每年有23万人因为免疫介导的药物过敏反应而住院。免疫机制所参与的药物过敏反应其临床表现十分复杂,涉及皮肤、肝脏、肾脏、心脏以及造血系统等多种组织和器官,病变时常表现为皮肤潮红、发痒、心悸、皮疹、呼吸困难,严重者可出现休克或死亡。药物在体内分布以及代谢的复杂性决定了在新药筛查过程中很难预测到会有药物不良反应的发生。肥大细胞是过敏反应的主要效应器,并可能通过分泌组胺以及各种炎症和免疫调节相关物质而在疾病中发挥重要作用。虽然都是经由免疫球蛋白(Ig)E抗体活化这种经典活化途径,肥大细胞的一个独特功能是他们对于一系列阳离子物质可产生与抗体无关的免疫应答。这些阳离子物质统称为基础促分泌素,包含与过敏性反应相关的炎症因子以及药物。如果我们能够找到人体内与这些基础分泌素特异性结合并产生药物不良反应的受体(靶点),那么就能从一定程度上为新药筛查提供有力的依据,为药物过敏患者带来福音。
值得庆幸的是,2015年Nature报道了一篇关于美国约翰霍普金斯大学B.D. McNeil和加拿大艾伯塔大学P. Pundir课题组联合研究的成果:他们通过引进一种小鼠模型来研究基础促分泌素刺激的肥大细胞活化以及确定MRGPRX2可作为一种潜在的治疗靶点来减轻一系列药物引起的不良效应。
相关研究表明哺乳动物和鸟类中存在基础促分泌素应答,许多基础促分泌素是内源性肽并常与炎症相关;然而他们只有在高浓度且独立于其经典受体时才会激活结缔组织的肥大细胞,因此必须有一种异于IgE免疫应答的刺激机制存在。与多聚阳离子化合物相结合的几种候选蛋白被认定为基础促分泌素受体。其中,MRGPRX2已经用大多数化合物筛选出来,然而对于小鼠MRGPRX2的研究很是复杂,因为包含人类4种类别MRGPRX的基因簇在小鼠体内均可急剧扩增,许多与MRGPRX2具有类似的序列同源性。因此,通过一个严格的聚合酶链反应结合反转录(RT-PCR)筛选出小鼠原发性肥大细胞中的一个基因条带——Mrgprb2,而MRGPRX1的同源基因没有相关的表达水平。课题组研究人员合成了Mrgprb2细菌人工染色体(BAC)转基因小鼠,其中eGFP-Cre重组酶的表达是在Mrgprb2启动子的控制下进行的。而Cre的表达模式显示Mrgprb2在结缔组织肥大细胞中出现特异性高表达。因此,基本促分泌素通过一种单一受体在体外和体内激活小鼠肥大细胞;而这种单一受体为Mrgprb2,系人类G蛋白偶联受体MRGPRX2的同源基因。
接着,研究人员使用锌指核酸为基础的方法,生成一个Mrgprb2编码区A4碱基对(bp)缺失的小鼠品系(Mrgprb2MUT小鼠)导致移码突变(这种突变是稳定可遗传的)(图1)来确定Mrgprb2是否是小鼠肥大细胞中的基础促分泌素受体。在这组实验中,Mrgprb2MUT作为一个功能无效点。实验结果显示,肥大细胞数在野生型和Mrgprb2MUT小鼠组织中类似,表明Mrgprb2不是肥大细胞存活或到达靶向组织所必需的;腹腔肥大细胞对抗IgE抗体和内皮素的反应类似,表明Mrgprb2突变不全是影响IgE或G蛋白偶联受体(GPCR)介导的肥大细胞信号转导。基础促分泌素48/80诱发气管收缩和后爪炎症(渗出和肿胀;图2a)在Mrgprb2MUT小鼠中几乎完全消失,而抗原和抗IgE诱发的反应(图2b)与野生型小鼠相似;另外4个基础促分泌素以及MRGPRX2激动剂PAMP(9-20)和皮质醇稳定蛋白(Cortistatin)都能强烈激活野生型而不是Mrgprb2MUT肥大细胞。因此,Mrgprb2是小鼠肥大细胞的基础促分泌素受体。

图1 Mrgprb2MUT功能敲除小鼠:Mrgprb2MUT开放阅读框的氨基酸翻译显示这种缺失可造成移码突变以及第一跨膜区后不久提前终止密码子(带星号部分)。Mut,移码缺失位点;TM1,跨膜1区。
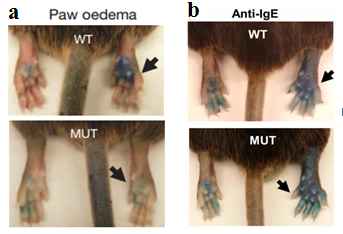
图2 Mrgprb2是小鼠肥大细胞基本的促分泌素受体,而IgE介导的炎症在野生型小鼠和Mrgprb2MUT小鼠中并无明显区别:(a)左,在注射48/80的15min后用伊万斯蓝染色的外渗物(右,箭头,10µg/ml, 5µl生理盐水稀释)或生理盐水组(左)的代表图片。右,15min后伊万斯蓝渗漏入足爪的量以及足爪厚度增加情况;(b)在足底注射抗IgE抗体15min后用伊万斯蓝色染色的外渗物(右,箭头,100µg/ml,7µl生理盐水稀释)或生理盐水组(左)的代表图片。
对于下一步研究,研究人员选择药物引起的反应(药物大多是阳离子,15%是过敏性质,大多与IgE抗体滴度不相关)来确定Mrgprb2是否是过敏性反应的因素。课题组采用的是肽类药物(大多是阳离子型),并且关注最常见的过敏性反应即注射部位反应(ISR),这些药物可在Mrgprb2依赖性方式下激活肥大细胞。选择缓激肽拮抗药物——艾替班特(易诱导ISR)进一步研究发现,与人类的ISR相似,艾替班特在临床浓度下可诱导野生型小鼠(而不是Mrgprb2MUT小鼠)出现广泛的出血和肿胀反应;用肥大细胞稳定剂酮替芬预处理的小鼠也显示无炎症,这有力地证明了肥大细胞可介导炎症;艾替班特可诱导野生型腹膜肥大细胞释放组胺,而Mrgprb2MUT肥大细胞释放的组胺大幅减少;IgE介导的组胺释放并不受Mrgprb2缺失的影响。这些数据使得我们更加能够期待药物介导的ISR可以通过靶点MRGPRX2或使用MRGPRX2激动剂功能更弱的多肽得以缓解。
随后,研究人员探讨了由小分子诱导的Mrgprb2诱发假性过敏反应的可能性。课题组通过静脉注射药物,静脉用药后的假性过敏反应症状在最严重时被称为过敏,包括皮肤潮红或皮疹、血压或心率的变化以及支气管痉挛。据报道,一种THIQ可提取一些烟碱受体拮抗剂非甾类肌松药物(NMBDs),而NMBDs通常用于手术以减少不必要的肌肉运动以及允许气管内插管可机械通气,其在手术过程中易诱发过敏反应,刺激组胺释放。研究发现,除了琥珀胆碱外的所有NMBD家族成员可按Mrgprb2依赖方式且在0.5%临床注射浓度下激活肥大细胞;4种允许静脉使用的药物可在Mrgprb2依赖性方式下激活Mrgprb2-HEK细胞、MRGPRX2-HEK细胞以及肥大细胞;最终选择环丙沙星做体内过敏实验,实验小鼠最常见情况就是体温下降,可能是血压和外周血管舒张功能的变化所致,高剂量的环丙沙星诱导产生体温的快速下降并且恢复很慢,而Mrgprb2MUT小鼠表现出相对更小的下降幅度并且恢复很快。这些结果表明通过Mrgprb2诱导的肥大细胞活化是氟喹诺酮类和其他药物的一个脱靶效应。
最后,研究人员确定了与假性过敏相关的药物是否通过MRGPRX2来激活人体肥大细胞。研究发现每一类具有代表性的被检药物都可诱发组胺、肿瘤坏死因子(TNF)、前列腺素D2(PGD2)以及β-氨基己糖苷酶从LAD2细胞中释放。重要的是,MRGPRX2 -siRNA处理的LAD2细胞在受到这些药物激发后释放的β-氨基己糖苷酶量与对照组siRNA处理的LAD2细胞相比显著减少,而与IgE介导的释放量相似。
本研究给予了我们关于IgE介导的肥大细胞信号转导通路(引发药物过敏)以外的一条非常重要的、隶属于药物不良反应的作用机制通路,即:基础分泌素(多为阳离子肽类药物)与体内肥大细胞受体MRGPRX2特异性结合,引发肥大细胞活化,刺激组胺释放。进而着眼于从抑制靶点MRGPRX2以及选用MRGPRX2激动剂功能更弱的多肽方面来缓解临床用药过程中产生的ISR等药物不良反应症状。关于MRGPRX2在药物诱导的假性过敏中所发挥作用的相关知识应该进一步扩大,原因有二:首先,配体结合需求研究应使交叉激活MRGPRX2的药物具有更多的特异性筛选方法;第二,筛选口服类药物可能发现更多的MRGPRX2配体,因为口服类药物常见的副作用就包括了胃肠道以及头痛等问题,这两者都可能有肥大细胞成分发挥作用。(来源:百替生物 作者:孙超)
原文摘要:
Identification
of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions
Mast cells are primary effectors in
allergic reactions, and may have important roles in disease by secreting
histamine and various inflammatory and immunomodulatory substances. Although
they are classically activated by immunoglobulin (Ig)E antibodies, a unique
property of mast cells is their antibody-independent responsiveness to a range
of cationic substances, collectively called basic secretagogues, including
inflammatory peptides and drugs associated with allergic-type reactions. The
pathogenic roles of these substances have prompted a decades-long search for
their receptor(s). Here we report that basic secretagogues activate mouse mast
cells in vitro and in vivo through a single receptor, Mrgprb2, the orthologue
of the human G-protein-coupled receptor MRGPRX2. Secretagogue-induced histamine
release, inflammation and airway contraction are abolished in Mrgprb2-null
mutant mice. Furthermore, we show that most classes of US Food and Drug
Administration (FDA)-approved peptidergic drugs associated with allergic-type
injection-site reactions also activate Mrgprb2 and MRGPRX2, and that
injection-site inflammation is absent in mutant mice. Finally, we determine
that Mrgprb2 and MRGPRX2 are targets of many small-molecule drugs associated
with systemic pseudo-allergic, or anaphylactoid, reactions; we show that
drug-induced symptoms of anaphylactoid responses are significantly reduced in
knockout mice; and we identify a common chemical motif in several of these
molecules that may help predict side effects of other compounds. These
discoveries introduce a mouse model to study mast cell activation by basic
secretagogues and identify MRGPRX2 as a potential therapeutic target to reduce
a subset of drug-induced adverse effects.
扫一扫,获取更多医学科研最新资讯!
【Medical Research微信公众号】 【百替生物官方微博】

