更新时间:2017-01-10 08:50 浏览: 次 作者:应雨妍 文章来源: 奇点网
如今,寻找能刺激自身免疫系统去对抗肿瘤的药物可以说是癌症治疗领域中最热门的研究方向了。但是强大如癌症,它们会巧妙地利用“免疫检查点”来抑制 T 细胞的免疫反应,让自己“逃过一劫”。
为了解决这个问题,科学家们又开发出了可以阻断免疫检查点的抗体蛋白,并使免疫细胞可以靶向肿瘤。但即使如此,免疫治疗药物的成功率依然不高,仅有 20-30% 的患者能从中获益。为什么会这样呢?纪念斯隆 - 凯特琳癌症中心的免疫治疗专家 Jedd Wolchok 认为,要么是肿瘤周围被激活的 T 细胞太少,要么是肿瘤表面的“肿瘤抗原”不够多,在 T 细胞面前“暴露得不够”[1]。

Jedd Wolchok
循着这个思路,来自芝加哥大学的化学家林文斌想出了一个办法,用辐射来解决这个问题!肿瘤学家们过去就已经在少数个例中发现过,接受了放疗的癌症患者的免疫系统似乎受到了“刺激”,更具有“攻击性”了,它不光消除了肿瘤,而且在没有接受放疗的身体其他部位也产生了免疫反应!由此,林教授就想出了这个利用辐射来“刺激”T 细胞,杀灭肿瘤和转移的癌细胞的办法。
林文斌教授大家可能不够熟悉,他其实是一位世界著名的华人化学家,1988 年毕业于中国科学技术大学,后赴美深造,目前是芝加哥大学的化学教授,在 2013 年,以“千人计划”身份受聘于厦门大学。2011 年,在汤森路透集团(ThomsonReuters)发布的 2000-2010 年全球顶尖一百化学家名人堂榜单中,林教授位列全球第 54 名,同时上榜的还有 11 位华人科学家。

林文斌教授
有了这个想法后,林教授想到了纳米材料,他希望用无毒的纳米粒子以前面我们提到的这种方式去让免疫系统变得更敏感,然后结合免疫检查点抑制剂,达到摧毁肿瘤的目的。他们的研究发表在了 12 月的《美国化学学会杂志》(《the Journal of the American Chemical Society》)上 [2]。林教授的团队设计制造了一种直径在 20-40 纳米之间的纳米粒子,这个大小足够“躲过”巨噬细胞,避免它们在靠近肿瘤前就被巨噬细胞吞噬掉。
这种纳米粒子的核心是化合物焦磷酸锌(ZnP),外层是光敏剂(pyrolipid,整个粒子后文简称 ZnP@pyro),研究人员还在 ZnP@pyro 的外层包被了聚乙二醇,有助于它们在血液循环中存活的时间更久。在光的照射下,光敏剂会产生活性氧簇(ROS)来杀死癌细胞,这是光动力疗法(PDT),同时还会产生免疫反应,这样再结合免疫检查点阻断疗法,就可以更有效地消除原发肿瘤,同时也抑制转移的癌细胞。
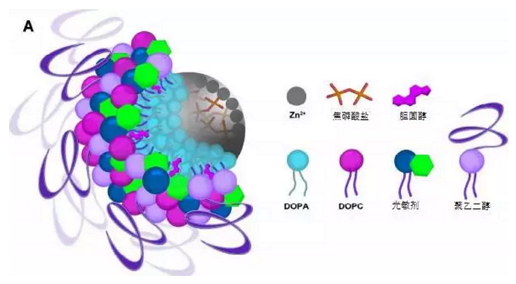
ZnP@pyro 结构示意图
具体是如何做到的呢?研究人员会先将 ZnP@pyro 注射到血液中,ZnP@pyro 会随着血液循环到达肿瘤的位置。由于肿瘤有复杂的脉管系统(包括血管和淋巴管),且脉管系统具有易漏性,但又缺乏淋巴节引流,所以这复杂的“脉管迷宫”是易进不易出,纳米粒子一到这里,就会被“困住”,积聚在此,继而被肿瘤细胞“抓进体内”。
研究人员一旦观察到 ZnP@pyro 被吸收,就会用一种特殊波长的近红外光(near infrared light,介于可见光和中红外光之间的电磁波)照射肿瘤。光被吸收后会激发附近的氧分子,产生一种高活性的单线态氧,这就像铁扇公主吞下了孙悟空一样,孙悟空一生气,就会在铁扇公主体内“折腾”,肿瘤就是这样被 ZnP@pyro 从内部撕裂的。
那么它又是怎么引起免疫反应的呢?单线态氧撕裂肿瘤细胞时会使许多新的肿瘤抗原暴露在树突状细胞的“面前”,树突状细胞(DC)是一种抗原呈递细胞,它能够摄取、呈递抗原,人体内的大部分 DC 处于非成熟状态,具有较强的迁移能力。此时的 DC 就像一位蛰伏已久的警察,他看到了自己等待多时的罪犯,就赶忙上前将他们一举抓获,然后呈递给法官,也就是 T 细胞进行“审判和制裁”。通过这样的过程,ZnP@pyro 帮助免疫系统实现更强的抗肿瘤反应,也就是像前面 Wolchok 教授说的后者那样,虽然 T 细胞的数量并没有增加,但是我们可以想办法让肿瘤“更多地暴露在 T 细胞面前”。
树突状细胞
在 2016 年 8 月的时候,林教授就曾在《自然 通讯》杂志上发表文章,他们用自己设计的一种纳米粒子以这种方式结合免疫检查点抑制剂对结肠癌小鼠进行了治疗 [3]。不过,他们使用的纳米粒子与这次的不同,其中包含了可以杀死癌细胞的化疗药物,所以这一次,他们希望能够排除化疗效果这个影响因素,将重点全部放在了免疫治疗上。
于是他们同样在小鼠体内做了实验,不过这次选用的是患乳腺癌的小鼠,乳腺癌对免疫治疗的敏感度不算高,因此,林教授的团队向这个“有难度”的癌症发起了挑战。他们把 ZnP@pyro 注射给小鼠,24 小时后进行照射,然后注射 PD-L1 抑制剂,每隔 24 小时进行一轮这样的治疗,如此三轮后,观察结果。实验效果没有辜负研究人员的苦心!这些乳腺癌小鼠们的原发肿瘤被消灭了,而且肺部的转移也基本上被清除了!这让研究人员们感到非常开心,林教授说,“我们惊讶的发现,没有化疗药物,我们也可以实现相同的效果。”
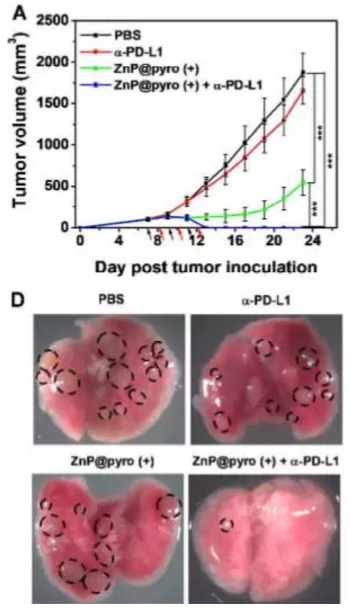
A:不同疗法下,原发肿瘤的生长曲线,图例中 PBS 为对照组,磷酸缓冲液
D:不同疗法下,小鼠肺部转移的治疗情况,黑色虚线圈内为转移瘤
并没有参与研究的 Wolchok 教授认为这是一个“经过深思熟虑”的治疗方法,而且实验结果也让人感到惊喜,他认为这值得尽快推进到人类实验中。林文斌教授已经成立了一家名为 Coordination Pharmaceuticals 的公司,目前正在寻求种子轮的融资,以便在今年下半年将这个研究带入临床中,奇点糕也希望林教授的研究能早日获得成功,造福更多的癌症患者。
参考资料:
[1] http://www.sciencemag.org/news/2017/01/nanoparticles-awaken-immune-cells-fight-cancer
[2] Duan X, Chan C, Guo N, et al. Photodynamic Therapy Mediated by Nontoxic Core-Shell Nanoparticles Synergize with Immune Checkpoint Blockade to Elicit Antitumor Immunity and Antimetastatic Effect on Breast Cancer[J]. Journal of the American Chemical Society, 2016.
[3] He C, Duan X, Guo N, et al. Core-shell nanoscale coordination polymers combine chemotherapy and photodynamic therapy to potentiate checkpoint blockade cancer immunotherapy[J]. Nature Communications, 2016, 7.