更新时间:2017-03-02 08:54 浏览: 次 作者:博医快车 文章来源: 生命科学联合中心
生命中心、北京大学生命科学学院李晴研究组近日在 DNA 复制偶联的核小体组装的机制方面做出重要突破,该工作发现单链 DNA 结合蛋白 RPA 通过结合组蛋白 H3-H4,形成一个高效的平台递呈组蛋白到新合成子链起始核小体组装。这一发现揭示一条全新的 DNA 复制和核小体组装的偶联机制,大大促进染色质复制领域的发展。该成果与 2017 年 1 月 27 号在线发表在国际权威学术期刊《科学》(Science)上(RPA binds histone H3-H4 and functions in DNA replication–coupled nucleosome assembly)。
真核生物的 DNA 主要储存在直径大小不足 10 微米的细胞核内。以人类细胞为例,如果将单个细胞中所有的 DNA 首尾相接,大约有两米长, 因此 DNA 需要高度折叠在染色质结构中。染色质的基本结构单位是核小体,主要由一段 147bp DNA 缠绕一个组蛋白八聚体核心约两圈组成,该八聚体核心包括一个组蛋白 H3-H4 四聚体和两个组蛋白 H2A-H2B 二聚体。核小体在辅助因子的作用下一层层折叠,组装形成高度有序的染色质结构,这一结构不仅能有效的压缩和保护 DNA,而且蕴藏丰富的表观遗传信息,在时间和空间上精细调节基因组的转录和复制,确保生命个体的正常发育。在染色质环境下,DNA 复制的同时染色质编码的表观遗传信息也需要稳定传承,这个过程对于维持基因组和表观遗传组的稳定性非常重要,而基因组和表观遗传组紊乱是癌症、神经退行性病变等疾病的主要原因之一。
染色质高度压缩的结构,对于 DNA 复制是一种阻碍,所以,在 DNA 复制过程中,为保证复制体顺利前行,复制叉前面母链 DNA 上的核小体需要解组装,复制叉后面两条新合成子链 DNA 则需要利用新合成组蛋白和从母链回收的旧组蛋白重新组装成核小体,这个过程被称为 DNA 复制偶联的核小体组装,是表观遗传信息传递的第一步。该过程的关键问题是如何将组蛋白 H3-H4 呈递到复制叉上,从而将 DNA 复制和核小体组装紧密偶联确保基因组稳定和表观遗传信息的正确传承。李晴研究组以酿酒酵母为模式物种,发现 DNA 复制叉上的重要因子 RPA 在这个过程非常重要。在 DNA 复制过程中,已知解旋酶 MCM 解开双链 DNA(dsDNA),产生单链 DNA(ssDNA),RPA 迅速结合刚生成 ssDNA,保护 ssDNA 避免损伤和产生二级结构,保证 DNA 复制正常有序进行。研究组首先发现 RPA 能够直接结合组蛋白 H3-H4,结合在 ssDNA 的 RPA 可以促进 H3-H4 和相邻的 dsDNA 结合,这是核小体组装的起始步骤;用一系列体内体外方法,包括建立一个新的 ReIN-Map 方法,定量分析了酵母体内全基因组水平新合成 DNA 上核小体的分布,证明 RPA 在 DNA 复制偶联的核小体组装过程中作用非常重要。据此,李晴研究组提出在 DNA 复制偶联的核小体组装过程中, RPA-ssDNA 复合物可以作为通用平台,方便多条分子伴侣呈递组蛋白通路连接到复制叉,从而促进子链 DNA 上核小体组装,揭示了一条新的将 DNA 复制和核小体组装相偶联的机制。RPA 的这个新功能对这个领域来说是出乎意料的,因为 RPA 是一个 ssDNA 结合蛋白,而核小体只能在 dsDNA 上形成。
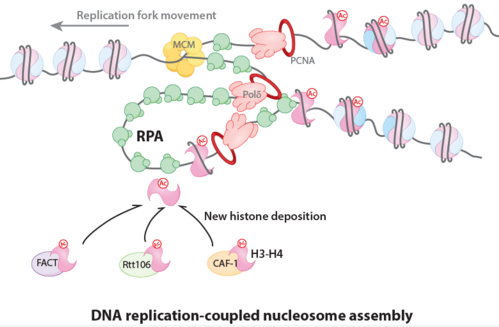
RPA 介导 DNA 复制偶联的核小体组装模型
2011 级 PTN 博士生刘少锋、2014 级生命科学学院博士生徐至韵和 2014 级前沿交叉学院博士生冷赫为本文的共同第一作者。生命中心、生命科学学院李晴研究员为该论文的通讯作者。美国 Weill Cornell Medical College 和 Houston Methodist Hospital 的 Kaifu Chen 博士参与指导了这项研究的生物信息数据分析。该研究工作得到了国家自然科学基金委、国家青年千人计划、北京大学 - 清华大学生命科学联合中心、北京大学蛋白质与植物基因研究国家重点实验室等的经费支持。