更新时间:2016-04-22 17:03 浏览: 次 作者:admin 文章来源:未知
前言:
2015年3月,国际著名医学杂志《Nature Medicine》报道了Dong-Seok Kim和Jeong Ho Lee等科学家的研究成果:FCDⅡ大脑体细胞中MTOR基因存在多个不同的错义突变,其中,p.Cys1483Arg、p.Leu2427Gln和p.Leu2427Pro能导致雷帕霉素靶蛋白MTOR激酶活性的提高,进而对大脑皮层神经元的成熟和迁移产生不良影响,进一步引起FCDⅡ,从而,导致顽固性癫痫的发生。
局限性脑皮质发育不良(focal cortical dysplasia, FCD),也称Taylor局部脑皮质发育不良。随着立体定向显微外科手术及功能影像学的不断发展,近年来,关于FCD的报道也逐渐增多。FCD属于神经元增殖异常性脑皮质形成障碍,其特点为局部脑皮质内呈现神经元与神经胶质细胞异常,可从最轻微局部皮质中断到重度皮质层状结构消失、内见大而怪异的细胞以及星形细胞增生,局部大脑皮质失去正常的6层有序构筑,神经元较大且发育不良,胶质细胞形态不典型,可见球形细胞,也混杂有发育正常的神经元,皮质下白质区可见胶质细胞增生。FCD区域兴奋性神经元增加,抑制性神经元减少,这是癫痫的解剖学基础。组织学上分为球形细胞与无球形细胞两类,后者又可分为Taylor型FCD(即皮质分层异常、神经元形态异常及巨大神经元)、细胞异常型FCD(即皮质分层异常与巨大神经元)和结构异常型FCD(即皮质分层异常),但有时也将Taylor型FCD涵盖为所有类型。通常,FCD型疾病的临床表现取决于FCD所在的部位及病变程度,其最常见的病症表现为顽固性癫痫,其他表现包括运动与感觉障碍(中央前、后回受累),较小区域的病变则无临床表现。无球形细胞者仅有癫痫而无神经功能障碍。
癫痫(epilepsy)即俗称的“羊角风”或“羊癫风”,是大脑神经元突发性异常放电,导致短暂的大脑功能障碍的一种慢性疾病。癫痫是一种严重的神经系统性疾病,其突出特征是大脑神经元异常同步化放电,并伴随有慢性和反复发作性。据相关数据统计显示,全球将近有7千万患者深受其害,它是神经系统疾病中仅次于脑卒中的第二大常见疾病。通常,癫痫的发病率与年龄有关。一般认为1岁以内患病率最高;其次,随着年龄的增加,患病的风险性会相对降低,即1~10岁的患病率会降低。报道显示,种族患癫痫症的概率无明显差异。目前为止,抗癫痫药物仅仅能控制约总癫痫患者数的三分之二,且不能从根本上改善其病理以及生理状况。
FCD是引起癫痫的一个很重要的原因,而且目前并没有有效的抗癫痫药物,该病通常在10岁内发病。一般需手术治疗,但是手术治疗后仍有癫痫发作的可能性,而且发作的几率也相当大,这是不容乐观的。之所以产后这种术后续发症,是因为目前的研究对FCD分子遗传病因的机理及其治愈尚缺乏深刻的认识,因此,对于更有效的FCD治疗策略仍待开发。依据FCD组织病理学的不同,其可以分为若干类型,其中FCDⅡ以皮质分层紊乱以及巨大神经元为特征。在FCD引起的癫痫患者中,有29%~39%为FCDⅡ。
2015年3月,国际著名医学杂志《Nature Medicine》报道了Dong-Seok Kim和Jeong Ho Lee等科学家的研究成果:FCDⅡ大脑体细胞中MTOR基因存在多个不同的错义突变,其中,p.Cys1483Arg、p.Leu2427Gln和p.Leu2427Pro能导致雷帕霉素靶蛋白MTOR激酶活性的提高,进而对大脑皮层神经元的成熟和迁移产生不良影响,这是产生FCDⅡ的重要原因,从而,激酶活性的提高进一步导致顽固性癫痫的发生。而雷帕霉素可以抑制这种效应。深入的研究表明MTOR可以作为FCD引起的顽固性癫痫的一个治疗靶点。
由于许多FCDⅡ的发生是散发性的,这暗示着,体细胞关键基因的突变调节大脑神经元细胞的生长和迁移可能是此疾病发生的一个潜在机制。FCDⅡ大脑核磁共振成像没有发现异常,显微检测手术标本发现在正常细胞周围存在分散变形细胞,这些放射和组织病理学发现,表明在手术切除组织中只有少部分体细胞发生突变。这种突变是不能通过毛细管Sanger测序和经典的全外显子测序(whole-exome sequencing, WES)检测出来的。在本研究中,采用深度的测序策略如深度WES、捕获追踪以及扩增子测序来检测突变基因以及相应的突变位点。
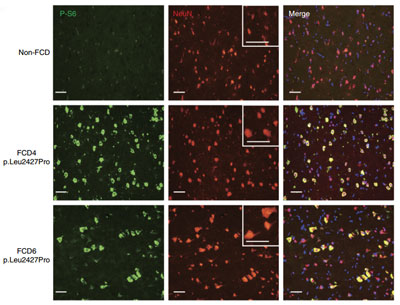
图为来自控制对照组和FCDII 患者的5个皮质区域的免疫组化染色
(采用mTOR通路标记P-S6和神经元标记NeuN.,标尺=50μm)
通过深度WES获得四组FCDⅡ样本。采用两种成熟的算法寻找影响大脑的体细胞突变:Virmid和MuTect。发现了MTOR基因三个突变:c.4448G>A, c.7255G>A and c.7280T>C。进一步在多个病例中采用捕获追踪和扩增子测序方法对MTOR基因外显子进行测序,发现了另外的八个错义突变:c.1871G>A(p.Arg624His),c.4348T>G(p.Tyr1450Asp),c.4447T>C(p.Cys1483Arg),c.5126G>A(p.Arg1709His),c.5930C>A(p.Thr1977Lys),c.6577C>T(p.Arg2193Cys),c.6644C>T(p.Ser2215Phe),c.7280T>A(p.Leu2427Gln)。这些突变都是发生在MTOR基因保守位点上。其中Cys1483和Leu2427位点在空间上是MTOR催化活性区域组成部分。近期,MTOR晶体结构研究表明,这种蛋白有一个内在的激酶活性中心和高度保守的催化中心,这表明底物招募的特异性是控制MTOR激酶活性的一个主要因素。
细胞水平以及体外激酶实验结果表明:p.Cys1483Arg、p.Leu2427Gln和p.Leu2427Pro能显著提高MTOR的激酶活性,这种效应能被雷帕霉素(临床上用于抑制MTOR激酶活性的药物)抑制。在含p.Leu2427Pro突变的FCDⅡ病人大脑神经元中,MTOR的激酶活性显著高于非FCD组,而且神经元明显较大。表明在FCDⅡ病人中MTOR的突变与MTOR的激酶活性以及神经元的成长息息相关。
采用子宫内胚胎电转技术对p.Leu2427Pro突变体体内功能进行研究。将构建好的p.Leu2427Pro突变载体和对照载体在E14电转到胎鼠大脑皮层中,4天后解剖观察。发现对照组神经元正常迁移,绝大多数神经元迁移到皮层皮质板层区(cortical plate, CP)。而电转突变载体组,神经元的迁移明显受到抑制,绝大多数神经元停留在中间带(intermediate zone, IZ)。电转突变载体p.Leu2427Pro的小鼠出生后大约六周(相当于人4岁)就有癫痫的发作,行为上和电信号上都有明显的癫痫特征,出现巨大神经元。这是由于MTOR的激酶活性升高,从而降低了癫痫发作的阈值。在癫痫发生后,使用雷帕霉素进行治疗,癫痫发作有显著的改善。
近年来,在神经系统性疾病中,体细胞突变受到了越来越多的重视。以上这些研究结果表明: 体细胞MTOR激酶活性可能是癫痫发生以及皮层发育异常的一个关键因素。尽管FCD发生的分子遗传学机制仍需要丰富,但是此研究揭示了特定基因的体细胞突变诱导FCD发生,这为以后的科学研究和临床治疗提供了基础。
(来源:百替生物 作者:Georg)
原文链接: (http://pan.baidu.com/s/1pJsYYAR )密码: (pb5f)