更新时间:2016-04-22 17:01 浏览: 次 作者:admin 文章来源:未知
星形胶质细胞脑肿瘤属于弥漫浸润性生长不可治愈的肿瘤,研究发现,星形胶质细胞可以形成超长膜突起,并利用这些微管在脑部进行扩张增殖。多细胞的通信通过微管得以连接。当这种网络受到损害,肿瘤微管就立即进行修复。放射治疗后,较之于未连接的细胞,微管连接的星形细胞瘤细胞得以大量幸存。其中,神经生长相关蛋白43(Cx43)与微管形成、肿瘤细胞增殖、细胞侵袭、细胞连接、抗辐射等均密切相关。星形细胞瘤可以形成多细胞网络功能结构,因此,肿瘤微管组织可以作为脑星形细胞瘤抗性治疗的重要靶点。
为了探究哺乳动物肿瘤膜上微管的形成与发育,研究人员运用多光子激光扫描显微镜体内观察鼠脑部胶质瘤。许多细胞形成超长的细胞突起,渗透正常脑。随着肿瘤生长,这些突起也在延长。运用突变特异性抗体检测发现,少突胶质细胞瘤有0.7%检测到细胞间肿瘤微管(1p/19q缺失),星形细胞瘤则有63%细胞间有肿瘤微管(1p/19q未缺失)。对105种人脑胶质瘤的实验结果显示,TM形成与肿瘤类型及等级息息相关,而1p/19q缺失与否则是TMs出现预测的较好检测标准。
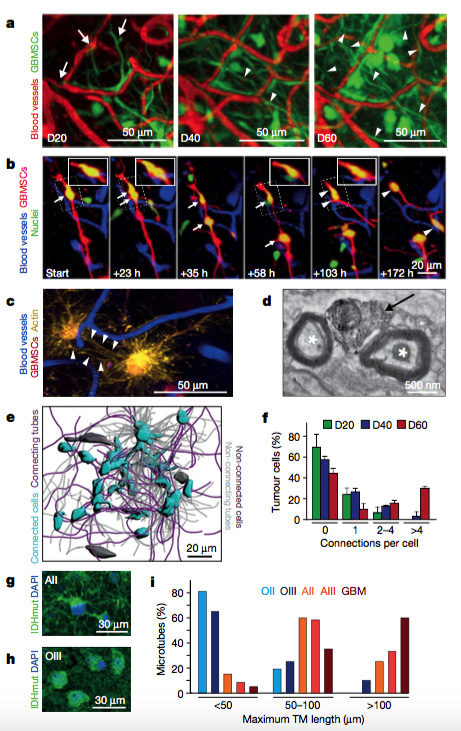
2.Cx43和TMs的连接
在多细胞网络中,细胞间钙波(ICWs)可以协调个体细胞活性, ICWs随着TMs的延伸而传播。通过超长高功能TMs相互连接是星形细胞瘤发生发展的重要机制。这个多细胞网络通过Cx43连接,随着放射治疗诱导的细胞毒性增加,钙水平也随即增加。说明钙稳态在其中起着重要作用。研究者推测,1p/19q缺失的胶质瘤同时导致TM相关间隙连接蛋白的蛋白减少。而对250个胶质瘤样本TCGA数据集的检测也表明,1p/19q缺失与否影响肿瘤基因的表达。间隙连接蛋白43出现差异表达,且为上调表达程度最高的蛋白。
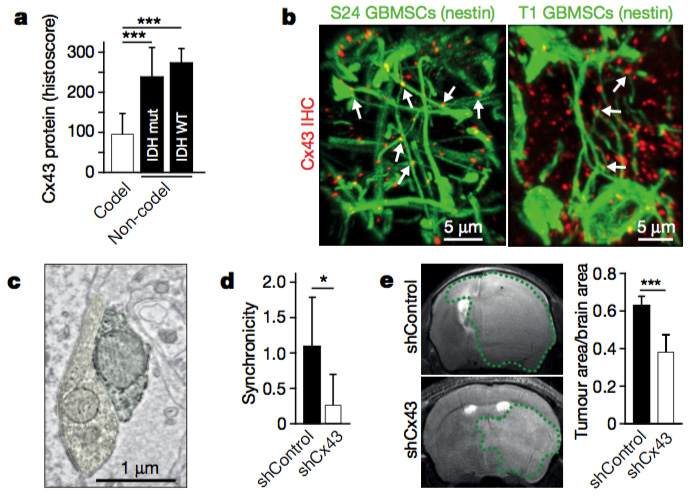
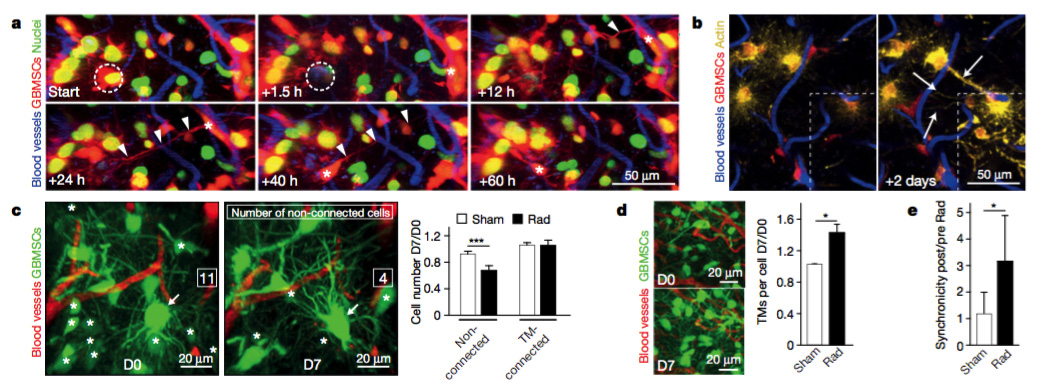
TM还具有损伤修复的能力,当TM网络一些细胞脱落,新的TMs会及时延伸补充。同时,放疗治疗后,TM未连接的肿瘤细胞大量死亡,而TM连接的肿瘤细胞得以存活,说明TM连接的肿瘤细胞网络,还可以抵抗放射治疗的细胞毒性。Cx43敲除将减弱TM网络的放疗抵抗性。生长突起的相关经典途径和物质包括整合素,磷脂酶C,Rho家族GTP酶,HMGB1,神经营养因子/TRK信号途径。
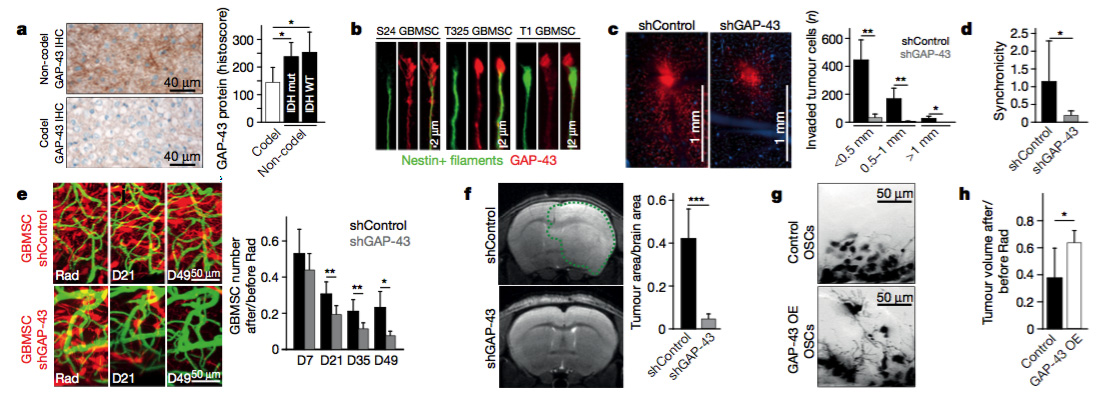
4.GAP43对TM生长和功能的重要性
在轴突生长锥中,神经营养因子受体信号激活GAP-43高表达,促进神经前体细胞迁移。GAP-43的过表达进一步促进膜上微管的生成。体内结果表明,GAP-43敲除后,TMs结构改变分支减少,TM连接和ICWs表达也减少,直接导致鼠脑部肿瘤形状减小。GAP-43过表达则导致大量TM形成,肿瘤细胞侵袭能力和放疗抗性增加。
肿瘤是个复杂的“器官”,上述研究结果加深了这一点。肿瘤中单个癌细胞相互之间通过有序的沟通相互作用,就好比每个细胞自身也是一个具有功能的“器官”。甚至,肿瘤还可以“劫持”正常组织生长程序,阻碍其发展。上述研究最重要的结论就是,通过GAP-43,TMs可以保证肿瘤的发生发展,网络交互以及抗性产生。药物靶向TM生成将成为脑部肿瘤治疗耐药的新靶点。
(百替生物:Bella)