更新时间:2016-04-22 17:03 浏览: 次 作者:admin 文章来源:未知
胰腺癌在所有癌症死亡率中排在第四位。对于多数胰腺癌患者来说,高转移性是该疾病患者致命的主要原因。因此了解该疾病的分子机制有助于准确地预测这些疾病的发展。在本研究项目中,研究人员通过构建转基因小鼠模型得到了相关数据。结果显示,杂合突变体DPC4/Smad4能够减弱KRAS细胞的转移能力,增加Trp53胰腺癌细胞的增殖能力。DPC4散失杂合性后,转移能力得到恢复。Runx3与DPC4两者共同协调并控制癌细胞的分裂和扩散之间的平衡。因此,Runx3作为抑癌基因和启动子来延缓细胞的扩散,并激活细胞转移程序来刺激细胞迁移、入侵和分泌蛋白质。这些发现可以用来预测可能的疾病以及调整相应的治疗策略。
RUNX3基因是目前研究最为广泛的抑癌基因之一。RUNX3蛋白是转录生长因子β(transforming growth factor-β,TGF-β)信号转导通路下游的一个转录因子,而TGF-β是许多细胞生长的有效抑制因子。该信号转导通路的紊乱可导致多种肿瘤的发生。TGF-β信号在细胞内的转导主要由人信号转导分子Smad蛋白介导,而在TGF-β信号通路中,Smad4是个关键的转录因子。TGF-β与RUNX3相互作用后可以激活Smad2和Smad3,从而诱导相关目的基因在细胞核内的转录和表达。因此,研究人员认为,RUNX3基因在TGF-β信号通路及Smad蛋白致瘤作用中起着重要角色。
DPC4基因,又称SMAD4基因,最初是在胰腺癌中被发现的,它位于染色体18q21.1上,其编码的SMAD4蛋白属于SMAD4家族,参与调控TGF-β信号通路,该信号通路可以抑制细胞的生长。SMAD4的表达缺失或突变,可诱发癌前疾病的发生,促进这些癌前疾病向肿瘤发展,并影响肿瘤的生物学行为,如侵袭和转移等。研究DPC4/SMAD4在肿瘤的发生发展中的作用,对于认识肿瘤的发生机制和预后有着积极的指导意义。
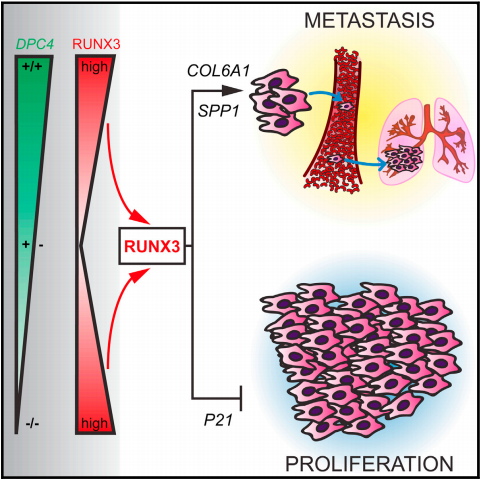
从上图可以看出,DPC4的杂合突变可以引起RUNX3基因表达降低,进而抑制癌细胞的转移,促进细胞的增殖;相反,DPC4如果是纯合子,则RUNX3基因将会过表达,这一方面会抑制癌细胞的增殖,另一方面则将促进癌细胞的转移。
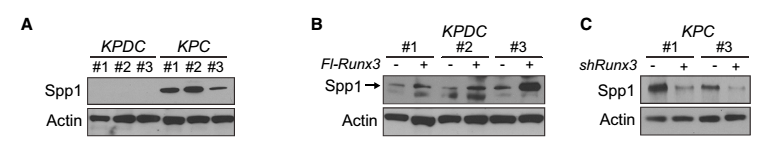
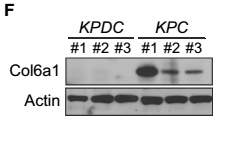
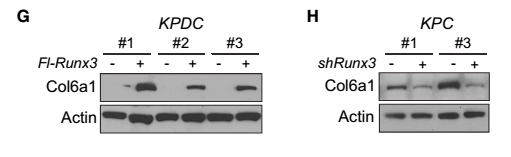
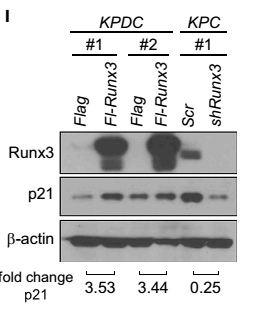
本文利用KPDC(KrasLSL-G12D/+;Trp53LSL-R172H/+;Dpc4flox/+;p48Cre/+)和KPC(KrasLSL-G12D/+;Trp53LSL-R172H/+;p48Cre/+)转基因小鼠进行相关实验。从图A、F可以看出,KPC小鼠的细胞Spp1和Col6a1蛋白有表达,而在KPDC小鼠的细胞中均无表达。由于Spp1和Col6a1蛋白能够促进癌症的转移,可见,Dpc4纯合子可引发癌症的转移,而Dpc4杂合子则能抑制癌细胞的转移。为了进一步探索Spp1和Col6a1与Runx3基因表达的关系,这里分别采用Runx3基因过表达组和干扰组进行相关实验。从图B、G中可以看出,KPDC小鼠的Runx3基因过表达组的Spp1和Col6a1蛋白表达量显著高于对照组;而从图C、H中则可以看出,KPC小鼠的Runx3基因干扰组的Spp1和Col6a1蛋白表达量显著低于对照组。由此可见,Runx3基因的表达量控制着癌细胞中Spp1和Col6a1的表达,进而控制着癌细胞的转移。从图I中可以看出,KPDC小鼠RUNX3基因过表达处理后,P21蛋白表达量增加,促进了癌细胞的增殖;而KPC小鼠RUNX3基因沉默后 ,P21蛋白表达量降低,抑制了癌细胞的增殖。由此推断出,RUNX3基因可通过调节P21基因的表达量进而控制癌细胞的增殖。
综上:
1. RUNX3可通过调控DPC4/SMAD4信号通路中相关基因的表达来影响胰腺癌细胞增殖和传播。
2. DPC4和RUNX3的水平可以帮助预测疾病的复发和反应,以提前做好临床疾病的预防。
RUNX3基因为癌症领域的研究提供了新的思路和方向,在未来癌症预测和治疗方面存在积极意义。(来源:百替生物 作者:毛赟燕)
原文摘要:
RUNX3 Controls a Metastatic Switch in Pancreatic Ductal Adenocarcinoma
For the majority of patients with pancreas cancer, the high metastatic proclivity is life limiting. Some patients, however, present with and succumb to locally destructive disease. A molecular understanding of these distinct disease manifestations can critically inform patient management. Using genetically engineered mouse models, we show that heterozygous mutation of Dpc4/Smad4 attenuates the metastatic potential of KrasG12D/+;Trp53R172H/+ pancreatic ductal adenocarcinomas while increasing their proliferation. Subsequent loss of heterozygosity of Dpc4 restores metastatic competency while further unleashing proliferation, creating a highly lethal combination. expression levels of Runx3 respond to and combine with Dpc4 status to coordinately regulate the balance between cancer cell division and dissemination. Thus, Runx3 serves as both a tumor suppressor and promoter in slowing proliferation while orchestrating a metastatic program to stimulate cell migration, invasion, and secretion of proteins that favor distant colonization. These findings suggest a model to anticipate likely disease behaviors in patients and tailor treatment strategies accordingly.
扫一扫,获取更多医学科研最新资讯!
【Medical Research微信公众号】 【百替生物官方微博】

