更新时间:2016-04-22 17:04 浏览: 次 作者:admin 文章来源:未知
p53,又叫做tumor protein p53,是人体抑癌基因,也是迄今发现与人类肿瘤相关性最高的基因。该基因编码一种分子量为53kDa的蛋白质,命名为P53。这种基因编码的蛋白质是一种转录因子(transcriptional factor),控制着细胞周期的启动,是否开始细胞分裂就由这个蛋白决定。p53基因的失活对肿瘤形成起着重要作用,有p53缺陷的细胞甚至在不利条件下会继续进行分裂。在所有恶性肿瘤中,50%以上会有p53基因的突变,而在很多人类大肠癌当中,则会出现p53基因的缺失。而p53基因的缺失又经常伴随一些编码酶亚基基因的缺失,此篇文章报道了其中一个具有代表性的RNA聚合酶II(负责催化合成mRNA)亚基缺失导致的癌细胞能被低浓度的自然毒素α-鹅膏蕈碱杀死的研究。
作用于促进细胞生长蛋白的癌症药物的数量在持续增长,而这类蛋白也能被基因突变所激活。但是抑制细胞增长的蛋白(被称为抑癌因子),则不能被突变或者缺失激活,并且也几乎没有治疗策略建立于其上。通常,抑癌因子的缺失会开辟一条特殊的细胞防御信号通路,比如我们现在已经发现的BRCA(乳腺癌基因)突变的乳腺癌细胞对腺苷二磷酸核糖(ADP-ribose)的依赖作用。遗憾的是,对抑癌因子的缺失目前还处在起步阶段,科学家还没有像研究其他基因变异情况时使用的常用方法去研究肿瘤抑制因子的缺失。其中,对肿瘤蛋白p53(肿瘤抑制因子的一种,p53能够控制细胞周期的正常运行,p53的缺失和变异会导致细胞的不正常增长)的研究是目前最重要的突破口。p53的编码基因TP53的变异是在12种最常见的癌症类型中发生的最普遍的一种,大约占到42%。然而,虽然在过去数十年间,科学家已经研究出了TP53明确的生物表征,但是到目前为止还没有研发出能够直接作用于p53信号通路的药物。研究人员发现在很多大肠癌中,TP53基因的缺失经常伴随着编码RNA聚合酶II一个亚基的基因的拷贝缺失。这种连带性缺失,会导致半合子细胞对聚合酶抑制剂(自然毒素α-鹅膏蕈碱)很敏感-- α-鹅膏蕈碱能抑制RNA聚合酶Ⅱ的延伸速率。
p53是一个转录因子,能够激活细胞周期检查基因的表达(如CDKN1A),从而控制细胞的周期性增殖。TP53基因的变异或者缺失,会促进癌细胞的增殖和存活。变异的p53缺少了转录活性,因此如果直接作用于小分子的话,就需要一个补偿机制。TP53的半合子缺失会导致p53的大量减少,为了稳定保持剩余p53,细胞会作用于MDM2蛋白—一种会促进p53降解的泛素连接酶。为了减少MDM2对p53的降解作用,科学家发现小分子nutlin-3a的衍生产物能干扰MDM2-P53之间的相互作用。这项发现已被纳入临床研究中。但是作用于p53缺失的治疗方法仍旧非常紧缺。
肿瘤基因组的缺失,并不局限于抑癌因子的缺失,经常和邻近或者“乘客”基因有关。越来越多的证据证明对“乘客”基因的间接遗传损伤可能会为癌细胞制造特殊的漏洞。
另一个研究是建立在人类肿瘤细胞模型观察上开展的(这些细胞的基因组至少有10%的缺失,并且主要是由于整个染色体或者染色体臂的缺失引起)。在部分遗失的基因中,这项研究的作者通过RNA干扰技术发现,无论在体内还是体外实验,PSMC2(编码一个必要的蛋白酶体蛋白的调节亚基—降解复合物)半合子缺失的卵巢癌细胞系对PSMC2表达降低非常敏感。研究人员把这个研究思路延伸到大肠癌的TP53的半合子缺失上,发现在染色体17上的遗传性缺失往往会同时牵扯到TP53和它的一个邻近基因POLR2A。POLR2A基因的功能是编码RNA聚合酶Ⅱ中最大的亚基A。这个亚基对人类所有细胞的mRNA转录都是必需的。POLR2A的半合子缺失会导致大肠癌细胞中RNA聚合酶Ⅱ数量的下降,造成这种癌细胞相较于正常细胞更易受转录抑制因子的影响。
在大肠癌细胞系中,研究人员使用化学和遗传学手段,观察到了一个现象(图1)。半合子POLR2A会导致大肠癌细胞相较于对照组对α-鹅膏蕈碱有10倍的敏感性,并且对RNA干扰更加敏感。这些发现都经过了仔细的对照确认,包括通过恢复POLR2A表达水平使细胞对α-鹅膏蕈碱脱敏以及设计成对细胞系进行比较(有或者没有POLR2A半合子)。为了获得这些发现的潜在临床相关性,作者构建了免疫缺陷小鼠人类肿瘤模型,进行了RNA干扰和α-鹅膏蕈碱功效研究。所有的研究都确定了POLR2A-半合子细胞对于转录抑制因子的敏感性。
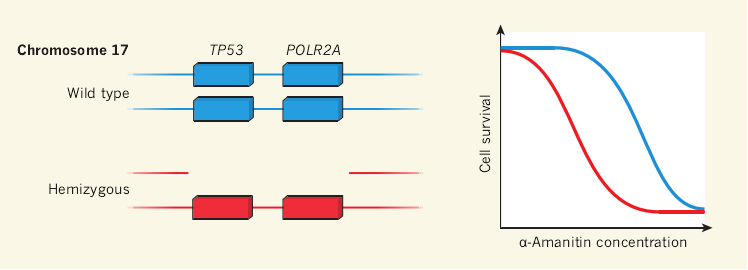
图1、大肠癌中对转录抑制剂的基因易损性
存在于很多人类大肠癌当中的染色体17上的大范围缺失会包含肿瘤抑制基因TP53和POLR2A(编码RNA聚合酶II的一个最大亚基)的半合子(单拷贝)缺失。这导致癌细胞中RNA聚合酶II丰度的下降,因此细胞能被很低浓度的自然毒素α-鹅膏蕈碱杀死(相较于能够表达双拷贝POLR2A的非肿瘤细胞而言)。
这个发现为人们打开了一个利用常见人类癌症类型转录抑制因子进行治疗的窗口。但这种方法还有很多的局限性:包括随着剩余完整POLR2A基因的复制(或者进一步扩增)带来的抗药性的可能,以及对自然毒素α-鹅膏蕈碱的依赖性。尽管如此,这些研究依然给予了人们充足的理由去研究癌症中的转录抑制因子和转录信号通路。下一步的工作可能会包括转录酶激酶抑制剂以及核染色质相关转录因子的调节。总而言之,这项研究提供了更多前期未被承认的基因组缺失的研究及其可行性,奠定了在癌症治疗过程中通过控制TP53变异的基础。(来源:百替生物 作者:于鸿燕)
扫一扫,获取更多医学科研最新资讯!
【Medical Research微信公众号】 【百替生物官方微博】

